Amyloidosis
|
Cave: notitiae huius paginae nec praescriptiones nec consilia medica sunt. |
| Amyloidosis | |
|---|---|
| Cognitores | |
| Disciplina medica | Endocrinologia Rheumatologia Cardiologia |
| ICD-9 | 277.3 |
| ICD-10 | E85 |
| Rationes clinicae | |
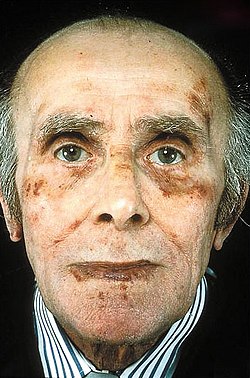
| Faciei aspectus morbi amyloidosis AL cum purpura (haemorrhagia) cute profunda circum oculos | |
| Pathologia | proteinorum accumulatio |
| Symptomata | Fatigatio, ponderis demintio, membrorum inferiorum tumescentia, spiratio reducta, haemorrhagia |
| Therapia | Chemotherapia Cellularum praecursoriae transplantatio (in parte) |
Amyloidosis est morbus metabolicus, quo intra corporis organa variosque textus proteina male plicata ita non solubiles, amyloideae fibrillae, extra cellulis formant aggreguntque. Proteinorum varii typi male plicari queant. Quamquam typi quattuor principales, secundum structuram proteinorum chemicam, AL enim, et AA, ATTR, Aβ2M nominantur[1], adhuc plus quam triginta quinque amyloidosum descriptae sunt[2].
Biopsiae ope specimina investigari possunt: sub microscopio materia amorphus, "sine forma", apparet. Denique microscopio electronico structura ramificationes fibrillarum amyloidearum tenuissimae et plurimae videri possunt. Coloratum cum rubro Congensi materia deposita rubre (congophilia) apparet, at conversa sub ad unum luce color eius ab rubro in viridem (birefringentia) convertitur. Ut deposita talia denique symptomata et signa procreant, amyloidosis dicitur.
Si amyloidosis totum corpus affect afficiat, fibrillae amyloideae in visceribus, vasorum sanguineorum parietibus, textu conectivo reperiuntur[3].
Exempla morborum male plicationis causa sunt morbus Alzheimerianus, morbus Parkinsonianus, diabetes mellitus (typi II), variae amyloidoses systemicae[4].
Initium morbi saepe inter annos 55 et 65 natos observatur. Dignoscuntur amyloidoses per urinanalysem, textuum biopsiam, examinationem medicam ut organorum incrementum cognoscendis.
Pathogenesis
[recensere | fontem recensere]Proteinorum structurae
[recensere | fontem recensere]In proteinis gradus quattuor separantur: structura primaria, secundaria, tertiana, quaterna. Structura primaria ad catenam aminoacidorum, post translationem, spectat. Mutationes simplices quoque, velut phosphorylationes et glycosylationes, ad structuram primariam valent. Structura secundaria ordinem illius catenae principalem describit. Distinguuntur hic helix alpha, facile in aqua solvens, atque lamina beta. Oritur hac de vincularum hydrogenii distributionibus inter catenae dictae greges peptidorum. Structura tertiana ordinem trium dimensionum refert, at structura tertiana inter duo proteina.
In amyloidosis pathogenesi generatio structurae secundariae mutatae, laminarum beta, quae male in aqua dissolvant, momentum maximum habet.
Proteina male plicata
[recensere | fontem recensere]In corpore proteina duobus modis generantur. Altera proteina plene ex aminoacidorum singularibus catenis formantur, altera per fragmentarum talium catenarum singularium coniunctionem. Earum fragmentarum coniunctiones haec sane non tantum stabiles sunt, ne iterum dissolvere possint. Praecipue reconiunctio sequens falsa in laminae beta structuram generationis amyloidi momentum habet.
Amyloidum et amyloidi formatio
[recensere | fontem recensere]Amyloida sunt proteina imprimis structurae laminarum beta[5]; hodie insuper variantes descriptae sunt[6]. Amyloidosis amyloidi formatione emanat. In neuropathologia ab amyloidosibus omnium organorum separantur morbi neurodegenerativa amyloidi formatione causa ut encephalopathiae spongiformes transmissibiles et morbus Alzheimerianus et morbus Parkinsonianus.
Organa affecta
[recensere | fontem recensere]Organa imprimis affecta sunt cor et renes. Alia organa quoque affecta possunt esse:
Symptomata et signa
[recensere | fontem recensere]Symptomata generalia sunt fatigatio gravior, ponderis deminutio conspicua, lingua maior cum impressionibus dentalibus, diarrhoea, tumescentia pedium. Alia symptomata ab textibus organisque affectis pendunt.
Symptomata cardiovascularia
[recensere | fontem recensere]- Cordis actio irregularis (arrhythmia cordis) cum pulsu irregulari
Genera amyloidosum
[recensere | fontem recensere]Frequentius sunt amyloidosis AL, amyloidosis AA, amyloidosis hereditaria ATTR (amyloidosis transthyretini).
Pinacotheca
[recensere | fontem recensere]-
Imago histologica, rubro Congensi colorate ("congophilia")
Notae
[recensere | fontem recensere]- ↑ Hazenberg B. P. C. (Mai 2013). "Amyloidosis: a clinical overview". Rheumatic diseases clinics of North America 39 (2): 323-45
- ↑ Sipe J. D., Benson M. D., et al. (Dec 2016). "Amyloid fibril proteins and amyloidosis: chemical identification and clinical classification International Society of Amyloidosis 2016 Nomenclature Guidelines". Amyloid 23 (4): 209-13
- ↑ Pepys M. B. (2006). "Amyloidosis". Annual review of medicine 57: 223-41
- ↑ Chiti F., Dobson C. M. (Iun 2017). "Protein Misfolding, Amyloid Formation, and Human Disease: A Summary of Progress Over the Last Decade". Annual review of biochemistry 86: 27-68
- ↑ Nizhnikov A. A., Antonets K. S., Inge-Vechtomov S. G. (Sep 2015). "Amyloids: from Pathogenesis to Function". Biokhimiia 80 (9): 1127-44
- ↑ Gallardo R., Ranson N. A., Radford S. E. (Feb 2020). "Amyloid structures: much more than just a cross-β fold". Current opinion in structural biology 60: 7-16
Nexus interni
Nexus externi
[recensere | fontem recensere]- Internationalis Societatis Amyloidosum situs interretialis (Anglice)
- Mayo Clinic de amyloidosi (Anglice)