Acidum
Appearance
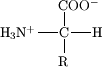
Acidum[1] in chemia, ubi plerumque definitioni Brønsted-Lowry obtemperatur, est quidque compositum quod libere ionta H+ (protona) in aquam emittit. Opponitur acido basis, quae H+ ex aqua extrahit vel aequivalenter OH- in aquam dissolvitur. pH acidi est infra septem.
Acida notissima sunt:
Bibliographia
[recensere | fontem recensere]- Ebbing, D. D., et S. D. Gammon. 2005. General chemistry. Ed. octava. Bostoniae, Massachusettae: Houghton Mifflin. ISBN 0-618-51177-6.
- Pavia, D. L., G. M. Lampman, et G. S. Kriz. 2004. Organic chemistry volume 1: Organic chemistry 351. Mason Ohii: Cenage Learning.
- Zumdahl. Chemistry. Ed. 4a.
Notae
[recensere | fontem recensere]- ↑ Vitruvius, De architectura 8.3.18: "quare autem discutiantur ex acidis eae res, sic possumus animadvertere."
Nexus interni
- Chemia
- Circumiectus
Nexus externi
[recensere | fontem recensere]| Vicimedia Communia plura habent quae ad acidum spectant (Acid, Acids). |
- Acida et Bases, scienceaid.co.uk (Science Aid)
- Diagrammata aequilibriorum inter acida et bases, www2.iq.usp.br (Curtipot, freeware)
- Index virium acidorum et basium communium, www.csudh.edu
- Notiones aciditatis,[nexus deficit] isites.harvard.edu (Chemistry 106)
- Summarium proprietatum acidorum, canadaconnects.ca
- "The UN ECE Convention on Long-Range Transboundary Air Pollution," www.unece.org
