Tumor systematis nervosi centralis
|
Cave: notitiae huius paginae nec praescriptiones nec consilia medica sunt. |

Tumor systematis nervosi centralis fit, cum intra systema nervosum centrale (SNC) - quod est cerebrum et medulla spinalis - cellulae non normales oriuntur[1]. Tumor cerebri fit cum intra cerebrum, tumor medullae spinalis cum intra medullam spinalem cellulae non normales oriuntur. Tumores SNC (systematis nervosi centralis) sunt tumores sensu stricto telarum neuroepithelii systematis nervosi centralis benigni vel maligni. At tumores sensu lato, et secundum classificationes currentes, sunt alii quoque tumores circum cerebrum ut meningiomata.
Tumor vocitatur quoque primarius, ut dum cellulae eius ex cellulis vel cerebri vel structurarum cerebro sociatarum, immediate ortae sunt. Vocatur tumor metastaticus, cum tumor ab alia corporis parte emanavit et metastasem in cerebrum diffundit (metastasis cerebralis). Nominatur metastasis etiam tumor secundarius. Invenitur, contra, primarius tumoris metastatici alibi, non raro in cute (melanoma), mamma, colo, renibus, nasopharynge. Pariter metastases spinales occurrunt.
Ad tumores dignoscendosque separandosque classificationes utiles sunt: Classificationes tumorum systematis nervosi centralis notae per Ordinem Mundi Sanitarium (OMS) divulgantur. Versio praesens (quinta) anno 2021 emanata est[2].
Secundum classificationem OMS 2021 tumorum SNC distinguuntur hodie: gliomata et tumores glioneuronales et tumores neuronales, tumores plexus choroidei, tumores embryonales, tumores pineales, tumores nervorum cranialium et paraspinalium, meningiomata, tumores mesenchymales et non meningotheliales, tumores melanocytici, tumores haematolyphoidei, tumores cellularum germinativarum, tumores regionis sellae, et metastases cerebrales (metastases in systemate nervoso centrali). Circiter 30 — 50 % omnium tumorum cerebri sunt gliomata. Ex eis 50 % maligna glioblastomata sunt, 25 % astrocytomata (quorum cellulae astrocytis similes sunt), 5 — 18 % oligodendrogliomata (oligodendrocytis similes), 2 — 9 % ependymomata (cellulis ependymoglialibus similes). Praeterea gliomata mixta, ut astrooligodendrogliomata vel oligoastrocytomata occurrunt.
Tumores maligni aut benigni esse possunt. Cum eo gradus instituendi ad tumoris progressum describendum necessarii videntur. De consuetudine gradus OMS 1-4 (ante 2021: I-IV) adhiberi solent. i Tumoribus SNC signum universale non est. Tumore crescente autem non raro nova, id sunt adhuc incognita, symptomata, ut capitis dolor, mane vomitus, convulsio[3] primo malum indicant.
Diagnosis medica per iconismum medicum et biopsiam et diagnosticam molecularem constituitur.
In tumores SNC tractando facultates therapeuticae diversae notae sunt, ut chemotherapia, operatio neurochirurgica, radiatio[4]. Ideoque decisiones therapeuticae in colloquiis tumorum elucidantur.
Expositio brevis systematis nervosi centralis[recensere | fontem recensere]

Compositum est systema nervosum centrale (SNC) e partibus duabus, cerebro et medulla spinali. Spectans ad tumores systematis nervosi centralis: Cellulae principales, quae structuram eius formant, sunt cellulae gliales ("cellulae sustinentes") et neurona ("cellulae nervales"). Circum et intra systema nervosum centrale inveniuntur canaliculi et spatia liquore cerebrospinale a plexibus choroideis in ventriculis cerebri sitis formata impleta. Origo cellularum SNC sunt praecursores cellulae embryonales, quarum pars dimidia iam ontogenese cerebri humani ineunte intra uterum apoptosis ope periit. In cerebri media parte sita est glandula pinealis, pars functionalis numeri circadianus, origo hormonis melatonini. Connectitur SNC per nervos craniales (vel cerebri) et paraspinales (medullae spinalis). Et cerebrum et medullam spinalem membranae diversae (meninges) circumcingunt.
Aliquae structurae praedictae necnon quaeque pars eiorum mutatione tumorosa affici possunt.
Classificatio Ordinis Mundi Sanitarii 2021[recensere | fontem recensere]
Secundum classificationem Ordinis Mundi Sanitarii (OMS)) anni 2021 distinguuntur hi tumores systematis nervosi centralis (SNC):
- gliomata et tumores glioneuronales et tumores neuronales,
- tumores plexus choroidei,
- tumores embryonales,
- tumores pineales,
- tumores nervorum cranialium et paraspinalium,
- meningiomata,
- tumores et mesenchymales et non meningotheliales,
- tumores melanocytici,
- tumores haematolymphoidei,
- tumores cellularum germinativarum,
- tumores regionis sellae,
- metastases in systemate nervoso centrali.
Gliomata, tumores glioneuronales, tumores neuronales[recensere | fontem recensere]
Gliomata describunt gregem heterogenum cellularum cellulis glialibus similium. A classificatione 2021 nominantur: gliomata diffusa typi adulti, gliomata diffusa gradus humilis typi paediatrici, gliomata diffusa gradus alti typi paediatrici, gliomata astrocytica circumscripta, tumores glioneuronales et neuronales, tumores ependymales.
Inter gliomata diffusa typi adulti inveniuntur astrocytoma IDH mutante, oligodendroglioma IDH mutante cum codeletione 1p et 19q, glioblastoma IDH typi nativi.

- Oriuntur astrocytomata ex astrocytis, qui cellulis glialibus attribuuntur. Inter tumores cerebri frequentissimos sunt et praecipue in media aetate occurrere solent. Varietates malignitatis per gradus 1-4 describuntur, ut astrocytoma pilocyticum (gradus 1), astrocytoma gradu humili (gradus 2), astrocytoma anaplasticum (gradus 3), glioblastoma seu glioblastoma multiforme (gradus 4). Aetiologia late incognita est, at mutationes geni Isocitrati dehydrogenasis, IDH1 enim vel IDH2 momentum habent, sicut inactivatio geni suppressoris tumorum p53, amissio allelorum et 1p et 19q, status geni ATRX, atque methylatio promotoris O6-methyloguanini methylotransferasis (MGMT). Anatomia atrocytomatum macroscopica et histologica diversa est.
Tumores plexus choroidei[recensere | fontem recensere]

Tumores plexus choroidis sunt tumores intracraniales rari, qui omnium tumorum cerebri 0.4-0.6% sunt. Derivata ab epithelio plexus choroidei haec neoplasmata intraventricularia papillaria (i. e. epithelio adnexa) formant papillomata plexus choroidei (PPC, gradus 1, bonae differentiationis) vel papillomata plexus choroidei atypica vel carcinomata plexus choroidei (CPC, gradus 3, valde maligna). Symptoma frequens est hydrocephalus[5]. Consociati sunt tumores plexus choroidei cum syndroma Aicardi, morbo Hippel et Lindau, haemangioblastomate. Interdum iconismus medicus pediculum tumoris, quo istud epithelio adnectitur, ostendit. Papillomata plexus choroidei benigna frequentius invenitur in ventriculo quarto, dum varietates ceterae saepius in ventriculis lateralibus conspicuntur.
Tumores embryonales[recensere | fontem recensere]
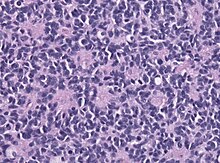
Inter tumores embryonales medulloblastoma valde malignum (ante 2021 gradus IV) invenitur, quod imprimis in verme cerebelli situm est, rarius intra hemisphaeriam cerebelli. Medulloblastoma extra cerebellum situm tumor neuroektodermalis primitivus (TNEP) nominatur. Medulloblastoma est tumor cerebri impubium frequentissimus (in impubibus 3-8 annos natis). Sub microscopio inveniuntur rosaria neuroblastica Homer et Wright. Iam ab anno 2016 qualitates geneticas, ut WNT acitivatum vel SHH activatum vel TP53 typus nativus , inclusae sunt[6]. Signa pressurae intracranialis auctae inveniuntur in dodrante aegrotorum. Therapia per resectionem (totalem, quoad fieri potest), radiotherapiam, chemotherapiam fit. Prognosis ab metastasium praesentia (circiter 50% aegrotorum affecti sunt) et tumoris genetica[7] pendit.
Alii tumores embryonales sunt tumor rhabdoideus teratoideus atypicus[8] (TRTA, imprimis in infantibus), tumor neuroepithelialis cribriformis[9] (TNECRI, fortasse varietas TRTA, cum prognosi salutariore), tumor embryonalis cum rosariis multilaminatis [10] (TERM, imprimis infantium, gradus 4, valde malignus).
Meningiomata[recensere | fontem recensere]

Meningiomata sunt tumores mesodermales, qui ab arachnothelo (neurothelo arachnoideae matris) meningum oriuntur. Classificatio 2021 partes meningiomatum diversorum proprias non habet. Inter primaria tumores intracraniales meningiomata frequentissima sunt. Maior meningiomatum pars benignae sunt, tamen ea diversos gradus dedifferentiationis exhibere possunt - a gradu 1 usque ad gradum 3 (anaplasticum vel malignum), quae diversis eventibus coniungungi solent[11]. Saepe situm invenitur meningioma in latere vel prope falcem cerebri vel in proximitate ossis sphenoidalis.
-
Meningioma cum osse sphenoidali coniunctum
Tumores haematolymphoidei[recensere | fontem recensere]

In classificatione 2021 lymphomata et tumores histiocytici nominantur. Non raro cum inflammatione praecedente videntur Lymphomata systematis nervosi centralis (SNC) sensu stricto: lymphoma SNC cellularum B magnarum diffusum primarium (LSNCP)[12], lymphoma SNC deficientiae immunitatis sociatum, granulomatosis lymphomatoidea, lymphoma cellularum B magnarum intravasculare. Rariores considerantur: lymphoma MALT[13] durae matris, alia lymphomata SNC cellularum B gradus humilis, lymphoma cellularum magnarum anaplasticum, lymphoma cellularum T vel cellularum NK et T. Tumores histiocytici includunt quae sequuntur: morbus Erdheim et Chester, morbus Rosai et Dorfman, xanthogranuloma iuvenile, histiocytosis cellularum Langerhans, sarcoma histiocyticum.
Metastases in systemate nervoso centrali[recensere | fontem recensere]

Inter Metastases cerebrales distinguuntur metastasis singularis, cum aliae metastases extra cerebrum inveninuntur. Metastasis solitaria autem significat nullam aliam metastasem in corpore exsistere. Tumor primarius saepe carcinoma pulmonum, mammarum, tractus gastrointestinalis, melanoma cutis, vel cancer renum est. Imprimis melanomata maligna[14] et cancer pulmonum cellularum parvarum periculum metastasum habent.
Metastases spinales de cancris primariis pulmonum, mammarum, prostatae, vel renum oriuntur. Signa clinica sunt dolores locales vel radiculares, parapareses, paraplegia, perturbationes vesicae urinariae[15]. Tractatio per glucocorticoida, resectionem (cum medulla comprimitur), radiotherapiam fit.
Classificationes Ordinis Mundi Sanitarii priores[recensere | fontem recensere]
Classificatio annis 2016 primo ad tumorum biologiam molecularem spectavit[16]. Haec classificatio histologica et molecularis ad inventiones scientificas respexit: mutationem geneticam IDH1[17] (vel IDH2), codeletionem et brachii brevis chromosomatis 1 et brachii longi chromosomatis 19 testimonis diagnosis oligodendrogliomatis[18] (una cum mutatione IDH1), methylationem promotoris MGMT (mensuram effectuum chemotherapeuticorum)[19], velut alios indicatores geneticos.
Classificatio anni 2007 distinxit inter tumores telarum neuroepithelii, tumores nervorum cranialium ac paraspinalium, tumores meningum, lymphomata ac neoplasmata haematopoietica, tumores gametorum, tumores regionis sellae, tumores metastaticos.[20]
Epidemiologia[recensere | fontem recensere]
In orbe terrarum incidentia omnium tumorum cerebri malignorum per annum aestimatur 3.7 per 100 000 virorum atque 2.6 per 100 000 feminarum. Videtur, ut incidentiae valores civitatum provectibilium (3.0 virorum, 2.1 feminarum) civitatibus oeconomice progressis (5.8 virorum, 4.1 feminarum) pauciores sint[21]. Inter tumorum genera autem magnae differentiae incidentiarum sunt. Inter tumores SNC, secundum numeros, metastases cerebrales sunt frequentissimae.
Anno 2023 investigatio propria ad praevalentiam tumorum systematis nervosi centralis (SNC) primariorum spectavit[22]: Omnium tumorum SNC praevalentia tumoris cerebri fuit 70.9%, medullae spinalis 12.2%; gliomatum 42.8%, astrocytomatum polycysticorum 3.8%, glioblastomatum 17.7%, adenomatum glandulae pituitariae 12.2%, oligodendrogliomatum 3.9%, tumorum ependymalium 3.2%, meningiomatum 24.1%, tumorum embryonalium 3.1%, schwannomatum 6.7%, medulloblastomatum 7.7%.
Diagnostica medica[recensere | fontem recensere]
Diagnosis medica facta est per anamnesem medicam, examen medicum (neurologicum), iconismum medicum, imprimis per iconismum resonantia magnetica factum (IRM), etiam per positronibus emissis tomographiam, et biopsiam stereotacticam ad gradum constituendum, et diagnosticam molecularem. Ex eis opinio prognosis evolvit: ubi situs est tumor, quis tumoris typus, quae mutationes geneticae ADN insunt, quam cito crescat, quae genera therapiarum, tolli potest tumor ope operationis neurochirurgicae, quaestiones valetudinis generalis futurae. Angiographia tantum ante operationem neurochirurgicam efficitur. Examinatio sanguinis ad glioblastomata dignoscenda investigatur[23].
Gradus tumorum systematis nervosi centralis[recensere | fontem recensere]
Extra nomenclaturam graduum ope progressus tumoris describi potest. Ante 2021 gradus OMS I-IV adhibebantur:
- Gradus I tumores sunt lente crescentes et non maligni. (Ab anno 2021: gradus 1)
- Gradus II tumores lente crescunt, interdum transformatio in gradum altiorem observatur. (Ab anno 2021: gradus 2)
- Gradus III tumores maligni sunt, saepe transformatio in gradum altiorem observatur. (Ab anno 2021: gradus 3)
- Gradus IV tumores sunt celeriter crescentes et maligni. (Ab anno 2021: gradus 4)
Respice gradus tumorum systematis nervosi centralis a gradibus aliorum corporis tumorum divergere!
Notae[recensere | fontem recensere]
- ↑ Institutum nationale tumorum (NIH): Informatio generalis de tumoribus systematis nervosi centralis
- ↑ Louis D. N. , Perry A., Wesseling P., Brat D. J., Cree I. A., Figarella-Branger D., Hawkins C., Ng H. K., Pfister S. M., Reifenberger G., et al. (Aug 2021). "The 2021 WHO Classification of Tumors of the Central Nervous System: a summary". Neuro-oncology 23 (8): 1231-51 doi:10.1093/neuonc/noab106
- ↑ Çetin Ö. E., İşler C., Uzan M., Çiğdem Özkara Ç. (Ian 2017). "Epilepsy-related brain tumors". Seizure 44: 93-7 doi:10.1016/j.seizure.2016.12.012
- ↑ Grunert M., Kassubek R., Danz B., Klemenz B., Hasslacher S., Stroh S., Schneele L., Langhans J., Ströbele S., Barry S. E., et al. (201). "Radiation and Brain Tumors: An Overview". Critical reviews in oncogenesis 23 (1-2): 119-38 doi:10.1615/CritRevOncog.2018025927
- ↑ Sethi D., Arora R., Garg K., Tanwar P. (2017). "Choroid plexus papilloma". Asian journal of neurosurgery 12 (1): 139-41 doi:10.4103/1793-5482.153501
- ↑ Jennifer Cotter A., Hawkins C. (Ian-Feb 2022). "Medulloblastoma: WHO 2021 and Beyond". Pediatric and developmental pathology 25 (1): 23-33 doi:10.1177/10935266211018931
- ↑ Schwalbe E. C., Lindsey J. C., Nakjang S., Crosier S., Smith A. J., Hicks D., Rafiee G., Hill R. M., Iliasova A., Stone T., et al. (Iul 2017). "Novel molecular subgroups for clinical classification and outcome prediction in childhood medulloblastoma: a cohort study". Lancet Oncology 18 (7): 958-71 doi:10.1016/S1470-2045(17)30243-7
- ↑ Nesvick C. L., Lafay-Cousin L., Raghunathan A., Bouffet E., Huang A. A., Daniels D. J. (Oct 2020). "Atypical teratoid rhabdoid tumor: molecular insights and translation to novel therapeutics". Journal of neuro-oncology 150 (1): 47-56 doi:10.1007/s11060-020-03639-w
- ↑ Johann P. D., Hovestadt V., Thomas C., Jeibmann A., Heß K., Bens S., Oyen F., Hawkins C., Pierson C. R., Aldape K., et al. (Iul 2017). "Cribriform neuroepithelial tumor: molecular characterization of a SMARCB1-deficient non-rhabdoid tumor with favorable long-term outcome". Brain pathology 27 (4): 411-8 doi:10.1111/bpa.12413
- ↑ Gualano F. M., Hassoun P., Carter C. L., Hanson D. (Mai 2023). "Embryonal tumor with multilayered rosettes: Post-treatment maturation and implications for future therapy". Cancer reports 6 (5): e1812 doi:10.1002/cnr2.1812
- ↑ Maggio I., Franceschi E., Tosoni A., Di Nunno V., Gatto L., Lodi R., Brandes A. A. (Iun 2021). "Meningioma: not always a benign tumor. A review of advances in the treatment of meningiomas". CNS oncology 10 (2): CNS72 doi:10.2217/cns-2021-0003
- ↑ Norrington M., Rathi N., Jenkinson M. D., Mills S. J. (Iul 2021). "Neuroinflammation preceding primary central nervous system lymphoma (PCNSL) - Case reports and literature review". Journal of clinical neuroscience 89: 381-8 doi:10.1016/j.jocn.2021.05.038
- ↑ TLMS - telum lymphoideum mucosae sociatum
- ↑ Nowacka A., Fajkiel-Madajczyk A., Ohla J., Woźniak-Dąbrowska K., Liss S., Gryczka K., Smuczyński W., Ziółkowska E., Bożiłow D., Śniegocki M., Michał Wiciński M. (Aug 2023). "Current Treatment of Melanoma Brain Metastases". Cancers 15: 4088 doi:10.3390/cancers15164088
- ↑ Aebi M. (Oct 2003). "Spinal metastasis in the elderly". European spine journal 23 Suppl 2 (Suppl 2): S202-13 doi:10.1007/s00586-003-0609-9
- ↑ Komori T. (Iul 2017). "The 2016 WHO Classification of Tumours of the Central Nervous System: The Major Points of Revision". Neurologia medico-chirurgia 57 (7): 301-11 doi:10.2176/nmc.ra.2017-0010
- ↑ Reuss D. E., Sahm F., Schrimpf D., Wiestler B., Capper D., Koelsche C., Schweizer L., Korshunov A., Jones D. T. W., Hovestadt V., et al. (Ian 2015). "ATRX and IDH1-R132H immunohistochemistry with subsequent copy number analysis and IDH sequencing as a basis for an "integrated" diagnostic approach for adult astrocytoma, oligodendroglioma and glioblastoma". Acta neuropathologica 129 (1): 133-46 doi:10.1007/s00401-014-1370-3
- ↑ Bigner S. H., Matthews M. R., Rasheed B. K., Wiltshire R. N., Friedman H. S., Friedman A. H., Stenzel T. T., Dawes D. M., McLendon R. E., Bigner D. D. (Aug 1999). "Molecular genetic aspects of oligodendrogliomas including analysis by comparative genomic hybridization". American journal of pathology 155 (2): 375-86 doi:10.1016/S0002-9440(10)65134-6
- ↑ Esteller M., Garcia-Foncillas J., Andion E., Goodman S. N., Hidalgo O. F., Vanaclocha V., Baylin S. B., Herman J. G. (Nov 2000). "Inactivation of the DNA-repair gene MGMT and the clinical response of gliomas to alkylating agents". The New England journal of medicine 343 (19): 1350-4 doi:10.1056/NEJM200011093431901
- ↑ Louis D. N., Ohgaki H., Wiestler O. D., Cavenee W. K., Burger P. C., Jouvet A., Scheithauer B. W., Kleihues P. (2007). "The 2007 WHO classification of tumours of the central nervous system". Acta Neuropathol 114 (2): 97-102 (PDF) (Anglice)
- ↑ Bondy M. L., Scheurer M. E., Malmer B., Barnholtz-Sloan J. S., Davis F. G., Il'yasova D., Kruchko C., McCarthy B. J., Rajaraman P., Schwartzbaum J. A., et al. (2008). "Brain tumor epidemiology: consensus from the Brain Tumor Epidemiology Consortium". Cancer 113 (7 suppl): 1953-68 doi:10.1002/cncr.23741
- ↑ Salari N., Ghasemi H., Fatahian R., Mansouri K., Dokaneheifard S., Shiri M. H., Hemmati M., Mohammadi M. (Ian 2023). "The global prevalence of primary central nervous system tumors: a systematic review and meta-analysis". European journal of medical research 28 (1): 39 doi:10.1186/s40001-023-01011-y
- ↑ Bark J. M., Kulasinghe A., Chua B., Day B. W., Punyadeera C. (Feb 2020). "Circulating biomarkers in patients with glioblastoma". British journal of cancer 122 (3): 295-305 doi:10.1038/s41416-019-0603-6
Nexus interni
Ad differentiam diagnosis medicae[recensere | fontem recensere]
Nexus externi[recensere | fontem recensere]
- cancet.net de tractatione tumorum systematis nervosi centralis (Anglice)
- Johns Hopkins medicine de therapia tumorum cerebri (Anglice)
- Mayo Clinic de diagnosi instituenda (Anglice)
Fontes Latinae[recensere | fontem recensere]
- Dissertatio inauguralis a Carolo Ludovico Henrico Calow delata (1826) De tumoribus cerebri, Berolini

